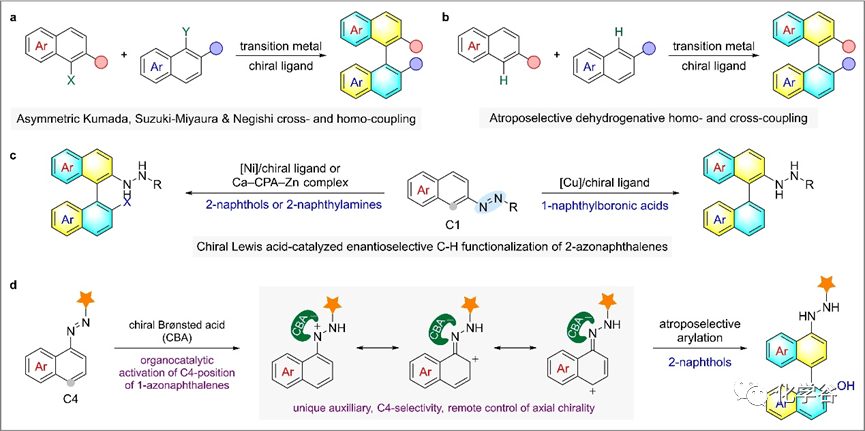
轴手性为材料化学和药物化学中的化合物设计提供了丰富的平台,手性会影响识别和相互作用。在不对称合成中,由于衍生的配体和有机催化剂取得了巨大的成功,轴手性联萘骨架在有机合成中得到了广泛的应用,因此,制备旋手性联萘的催化方法正在不断发展。
(图片来源:AICE)
近日,南方科技大学谭斌团队通过合理选择酰基咪唑啉酮作为活化基团,并使用手性Brønsted酸(CBA)催化剂,实现了1-偶氮萘与2-萘酚的高效交偶联反应,反应具有独特的C4选择性和良好的对映选择性。该反应可耐受多种官能团,并可将产物立体保留转化为其他双萘基化合物。
在优化研究之初,作者选择1-偶氮萘衍生物1a与6-溴萘-2-醇(2a)在CHCl3中的室温偶联反应作为模型反应。首先作者考察了在3,3'位置上携带不同侧臂的H8-BINOL衍生CPA催化剂的性能,发现2,4,6-三取代苯基的C5具有最好的产率和立体选择性(72%和55% ee)。酸性更强的N-三氟酰磷酰胺C8在效率(78%)和立体控制(67% ee)方面表现更好。其他CPAs以及基于BINOL和SPINOL(1,1 ' -螺比烷-7,7 ' -二醇)支架的磷酰胺衍生物的效果也不佳。当用(R)-C8代替CHCl3在氯苯中反应时,产率(82%)和ee(71%)都略有提高。虽然在氯苯和CH2Cl2中进行的反应产率相似(92%),但后者得到更好的产物ee(84%对74%)。较低的反应温度(- 20°C相对于室温)有利于立体选择性(91%对84% ee)。在此条件下,与加入水(87% ee)相比,加入分子筛可获得94%的ee,同时保持99%的产率。所有这些底物反应生成产物 6-10,产率为99%,并且在氢( 6)、苯基( 7)、苄基( 8)和甲氧羰基取代基( 10)存在下,对映控制性一般较好。然而,叔丁基(9)取代基的ee仅为64%,这可能是由于空间体干扰了催化剂的识别。另一方面,恶唑烷酮衍生物( 11)得到了中等81%的ee,即使产物收率仍然很高(99%)。

(图片来源:AICE)
在确定了最佳反应条件后,作者对2-萘酚2的底物范围进行了考察。如下图所示,在温和的条件下,大量的N -三氟基磷酰胺(R)-C8催化了大量2-萘酚与1-偶氮萘衍生物 4a的交叉偶联,产率高达99%,ee达到98%。首先作者评估了具有广泛电子性质的C6取代基。对于具有吸电子功能的卤素( 5,12)和羧酸酯( 13-15),芳基化反应的产率很高(大部分为99%),ee也很好(90 - 98%)。相比之下,富电子取代基如甲氧基( 16)、硅氧基( 17,18)、邻苯基( 19)和异丙基( 20)的ee值略低(84-90%)。更多的电子中性类似物也适用于这些条件。在烯烃( 22)、炔( 23)、苯基取代基( 24-26)、S-杂芳烃( 27,28,30)和o -杂芳烃( 29、31)存在的情况下,除2-萘酚( 21)的ee达到82%外,芳化反应是高效的(93-99%)和选择性的(87-97% ee)。

(图片来源:AICE)
为了进一步探索这种有机催化交叉偶联过程的普遍性,作者继续测试了1-偶氮萘衍生物的适用性。作者研究了不同电子性质的萘取代基在C3、C6、C7和C8位置上的相容性。这些底物绝大多数在5分钟内完全转化,得到了高产量(大多数为99%)的双萘基轴异构体( 43-53)。三氟酸酯( 43)、取代苯基( 44,45,47)和S-杂芳烃( 46,48),同时获得良好的ee(83 - 90%)。3-甲基取代1-偶氮萘( 49)具有相同的反应活性,但对映选择性显著下降(66% ee)。值得注意的是,在偶氮基团附近加入C8取代基,如卤素( 50,51)、苯基( 52)和2-噻吩基( 53),可以提高光学纯度(91-96% ee)。

(图片来源:AICE)
参考文献:Organocatalytic Atroposelective Cross-Coupling of 1-Azonaphthalenes and 2-Naphthols. ACIE, 2023, DOI: 10.1002/anie.202303128返回搜狐,查看更多

