新冠病毒(SARS-CoV-2)具有高度传染性,目前的检测均基于实时逆转录PCR检测技术,虽然效率高,但其技术要求高且价格昂贵,不适合资源相对稀缺的地区大规模使用。
据麦姆斯咨询报道,江苏省原子医学研究所谢敏浩教授课题组基于CRISPR/Cas12a,开发了一种稳健且高灵敏度的电化学发光(ECL)生物传感器平台,用于检测SARS-CoV-2 RdRp(RNA依赖性RNA聚合酶,简称RdRP)基因。相关研究内容发表在 Chemical Engineering Journal 上。
为了构建该生物传感器平台,研究人员在ECL生物传感器电极表面修饰DNA四面体结构,DNA四面体可以与DNA1形成DNA三链复合物,在核酸扩增反应的初始状态下,引入两个发夹DNA(H1和H2),在存在核酸外切酶III(Exo III)的情况下,可以同步切割、释放H1a和H2a。只有当H1a和H2a同时存在时,才能形成H1a/H2a双链,从而激活CRISPR/Cas12a的活性,并允许CRISPR/Cas12a切割DNA1(图1B)。如果反应体系中不存在目标物质,则无法形成H1a/H2a双链,也无法激活CRISPR/Cas12a的活性并切割DNA1。其中体系中的DNA1与电极表面的DNA四面体结合将引起ECL信号的变化,特别的是,该生物传感器平台可以在pH=10时“再生”(图1A),使其能够持续长期使用,从而准确监测待测核酸浓度。
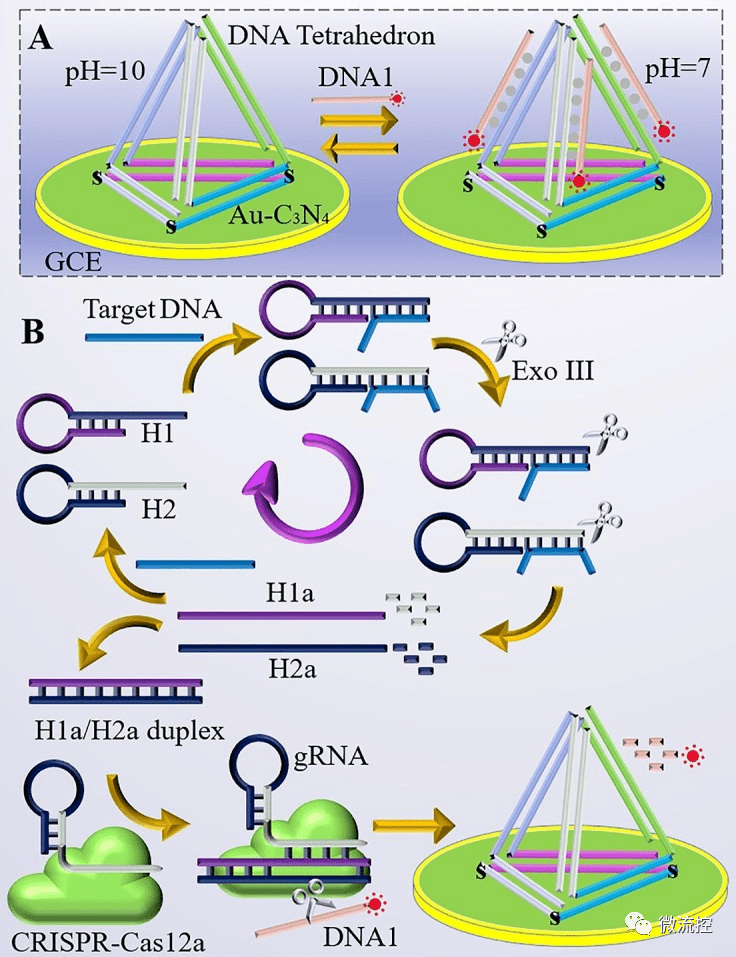
图1 基于CRISPR/Cas12a反式活性测定SARS-CoV-2 RdRp基因的pH诱导再生生物传感器示意图
为了进一步研究该传感器平台的特征,研究人员首先通过透射电子显微镜(TEM)对合成的Au-g-C₃N₄进行表征,观察到金纳米粒子的直径约为17nm,且均匀分散在C₃N₄纳米片的表面(图2A),此外还通过紫外表征发现合成的Au-g-C₃N₄将会在360nm和520nm之间有特征峰(图2B),介于AuNPs(520nm)和g-C₃N₄(360nm)特征峰之间,并通过能量色散X射线光谱仪(EDX)进行元素分析(图2C、D),均表明Au-g-C₃N₄成功合成;通过聚丙烯酰胺凝胶电泳(PAGE)表征DNA四面体的成功合成(图2E)。

图2 Au-g-C₃N₄和DNA四面体的表征
在本研究中,发光信号最初来源于g-C₃N₄,其可能的发光机理如下:g-C₃N₄在外加电压下获得一个电子,并转化为g-C₃N₄(1);S₂O₈²⁻在外加电压下获得一个电子,并降低为SO₄²⁻和SO₄⁻(2);SO₄⁻和 g-C₃N₄⁻之间发生电子转移,并且 g-C₃N₄⁻在激发态下变成g-C₃N₄*(3);g-C₃N₄*的激发态完成了电子跃迁,并转变为基态g-C₃N₄,同时在460nm处产生光(4)。

为进一步表征pH介导再生生物传感器逐步修饰过程的电化学响应,研究人员采用了循环伏安法(CV)。裸玻碳(GCE)电极的CV曲线(曲线a)显示了最大电流峰值。当Au-g-C₃N₄(曲线b)沉积在电极表面时,电流峰值显著降低。当DNA四面体和6-巯基己醇(MCH)(曲线c)继续在电极表面进行进一步修饰时,电流峰值继续降低,表明不良导电物质吸附在电极表面,这与DNA四面体和MCH的绝缘性能一致。DNA1继续通过四面体吸附在电极表面后,电流继续减少(曲线d),导致电流峰值出现类似的减少。同时,通过图3B所示的电化学阻抗谱(EIS)对pH介导再生生物传感器的逐步构建过程进行了表征。电化学CV和EIS表征均证明成功合成了pH介导再生生物传感器。研究人员发现60min为Exo III辅助扩增反应时间的最佳条件(图3C),90min后三链核酸形成达到稳定(图3D)。

图3 使用循环伏安法和电化学阻抗谱法表征生物传感器的构造
最终将构建的比率ECL生物传感器在优化条件下用于检测SARS-CoV-2 RdRp基因。图4A描绘了ECL信号随SARS-CoV-2 RdRp基因浓度增加的变化。发现ECL(620nm)/ECL(420nm)的变化值也与ECL(620nm)/ECL(420nm)呈线性关系(图4B):Y=6.466 × 10⁻⁴X-0.034,R²=0.9950,其中Y是ECL(620nm)/ECL(420nm)的比值,X是RdRp基因的浓度,根据检测极限(LOD)的计算公式:LOD=3σ/k,该生物传感器的LOD为43.70aM。

图4 不同靶标DNA浓度下ECL及ECL(620nm)/ECL(420nm)信号的变化
将修饰后的电极浸入含有1pM SARS-CoV-2 RdRp基因的PBS中,连续扫描10个循环。ECL信号在460nm(图5A)的相对标准偏差(RSD)为1.7%,ECL信号稳定在620nm(图5B)时RSD为2.5%,这些实验结果均表明该生物传感器具备优异的稳定性。最后,研究人员研究了构建的生物传感平台在不同pH值下的pH介导再生。研究发现,当生物传感器在TAE缓冲液(pH=10.0)中培养时,形成三链DNA的生物传感器可以在该pH值下使得DNA从电极表面解离而再生(图5D)。

图5 pH诱导的再生生物传感器的稳定性和选择性
总体来说,谢敏浩教授课题组提出的基于CRISPR/Cas12a的pH介导再生生物传感器,其用于诊断SARS-CoV-2 RdRp基因的检测灵敏度可达到43.70aM,具有临床应用的潜力。
论文链接:
延伸阅读:
《即时诊断应用的生物传感器技术及市场-2022版》
《分子诊断技术与市场趋势-2020版》 返回搜狐,查看更多

