2021年11月2日,南洋理工大学缪岩松课题组与福建农林大学和南方科技大学合作在 Plant Cell杂志发表了题为“ Membrane nanodomains modulate formin condensation for actin remodeling in Arabidopsis innate immune responses”的研究论文,揭示了植物通过remorin蛋白促进formin蛋白在细胞膜的分子聚集影响拟南芥先天免疫反应的肌动蛋白重塑机制。

https://doi.org/10.1093/plcell/koab261
生物活性大分子在细胞膜上能够形成纳米级到微米级的团块(或者说分子相变)帮助细胞启动或者相应特定信号。在植物病原菌或微生物相关先天免疫的分子模式(PAMP or MAMP)过程中,细胞骨架中的肌动蛋白会经历快速的重塑过程。这种过程是受到一些蛋白凝聚和remorin蛋白的自组装调控。这种通过纳米结构区域和remorin介导的对植物细胞的调控过程能够创造空间上的生化反应区间,并且对膜理化性质进行精细调控,更好在植物体内转导免疫信号。
植物核酸I型formin作为植物的分子开关,能够在PAMP诱导下激活拟南芥的肌动蛋白聚合。由于其结构上具有N端胞外域和跨膜域,能够将formin固定在细胞壁和质膜上。而植物PTI的激活诱导I型formin的局部招募和固定,并通过形成二聚体的分子间相互作用诱导formin蛋白的聚集,使其在肌动蛋白成核发挥作用。类似的机理比如支链肌动蛋白核子Arp2/3复合体也能够在哺乳动物细胞免疫反应激活肌动蛋白重塑过程。植物相变现象近年来研究方兴未艾,前人研究表明remorin参与拟南芥质膜受体和辅酶转运体的表面聚集,但是其调节自组装和其他相关生物分子组装的详细分子机制仍然不清楚。
作者构建了融合了C端GFP的formin过表达稳定转基因拟南芥品系AtFH6-GFP,发现在细菌感染前AtFH6-GFP显示出弥漫性和明显的点状分布,而接种Xcc 8004后发现AtFH6-GFP的强度逐渐增加(图1)处理幼苗也获得类似结果。利用flg22和elf26处理拟南芥也发现formin聚集现象。作者进一步利用同样的荧光系统观察 rem1.2 和 rem1.3 突变体(Remorin的同源蛋白)在处理前后的变化,发现AtFH6-GFP在 rem1.2 1.3c 中显示的强度明显低于WT植株。另外,在体外actin组装实验上,增加处理后WTd的F-actin占有率明显降低,而 rem1.2 1.3c 突变体则没有这种现象。这些数据表明,由宿主PTI反应介导的formin聚集和随之而来的F-actin重塑明显依赖于remorin。
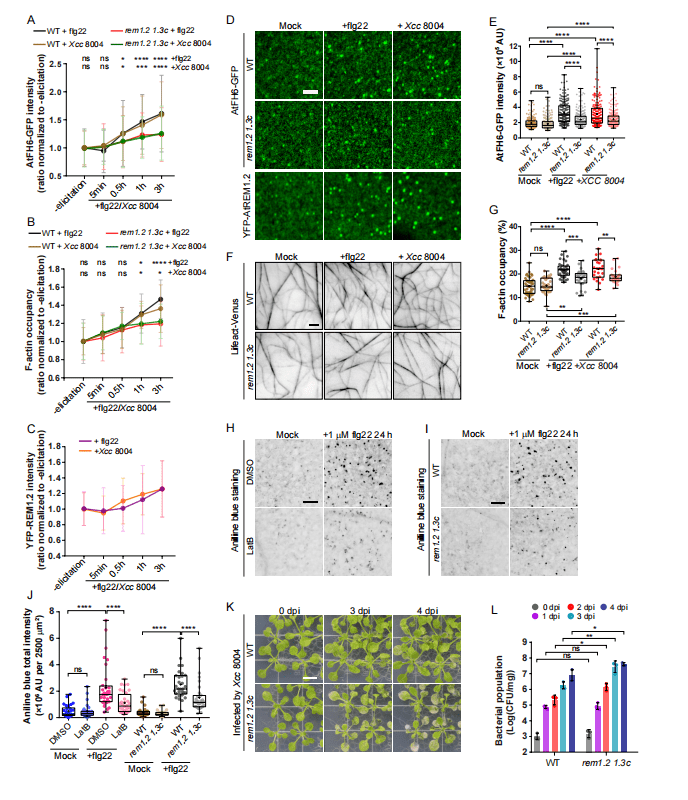
图1 Remorin介导拟南芥formin聚集和肌动蛋白多聚化
作者进一步研究remorin是否能够招募formin,作者在 rem1.2 背景下共同表达AtREM1.2和AtFH6-GFP。作者观察到Scarlet-AtREM1.2在质膜上的呈现点状分布,与AtFH6-GFP无共定位。而10M的flg22激发3小时后,carlet-AtREM1.2和AtFH6-GFP的聚集共定位(图2)。这种共定位能够被MCD、SMIFH2或LatB共同接种而消失。这表明在PTI信号传导过程中,纳米域组装、AtFH6二聚体之间的相互作用以及肌动蛋白细胞骨架的完整性依赖AtREM1.2-AtFH6复合物的形成。作者又构建另外一个稳定转基因系共同表达可诱导的mRuby2-AtREM1.2和稳定的Lifeact-Venus。通过雌二醇处理诱导AtREM1.2过表达,发现体内肌动蛋白聚合增加。用5M LatB处理使F-肌动蛋白解聚,再使肌动蛋白细胞骨架重新聚合发现诱导AtREM1.2过表达,在相同条件下导致肌动蛋白数量增加。这些数据共同表明,remorin的大分子组装直接招募和凝聚formin到纳米域中。
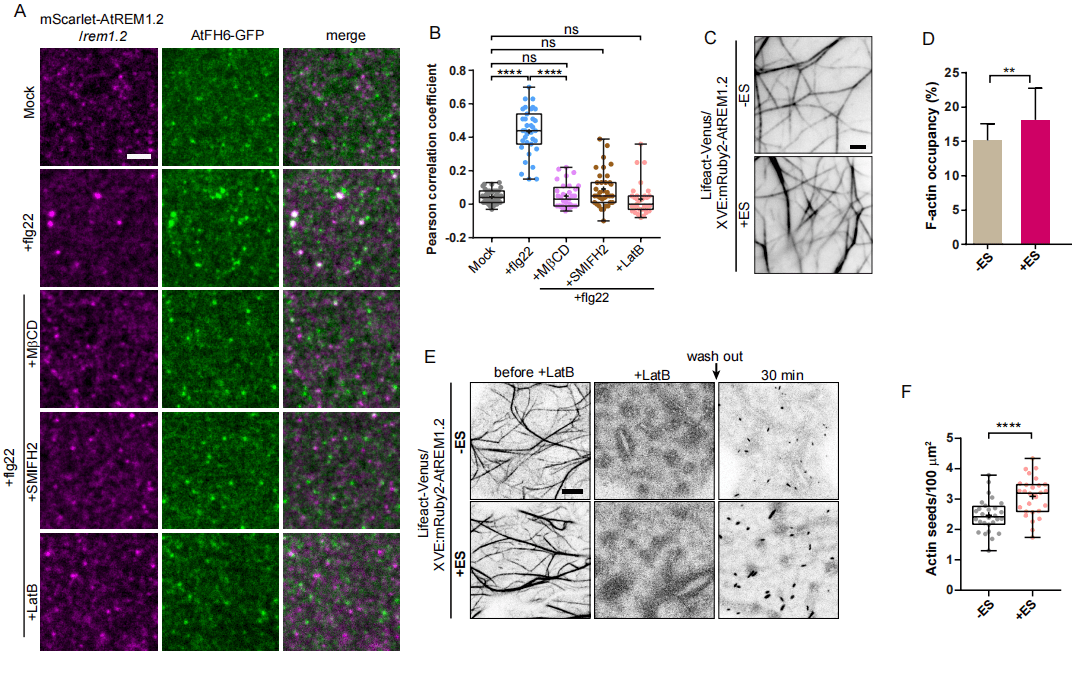
图2 Remorin 招募formin聚集促进肌动蛋白成核活性
作者接下来研究是否上述的聚集是存在formin与remorin的相互作用。作者开发了一个支持性脂质双层体外重组系统研究remorin-formin在脂质双层表面的相互作用,以及潜在的formin凝结和通过大分子组装激活成核活动。结果发现REM1.2与formin直接相互作用促进了体外肌动蛋白的成核(图3)。
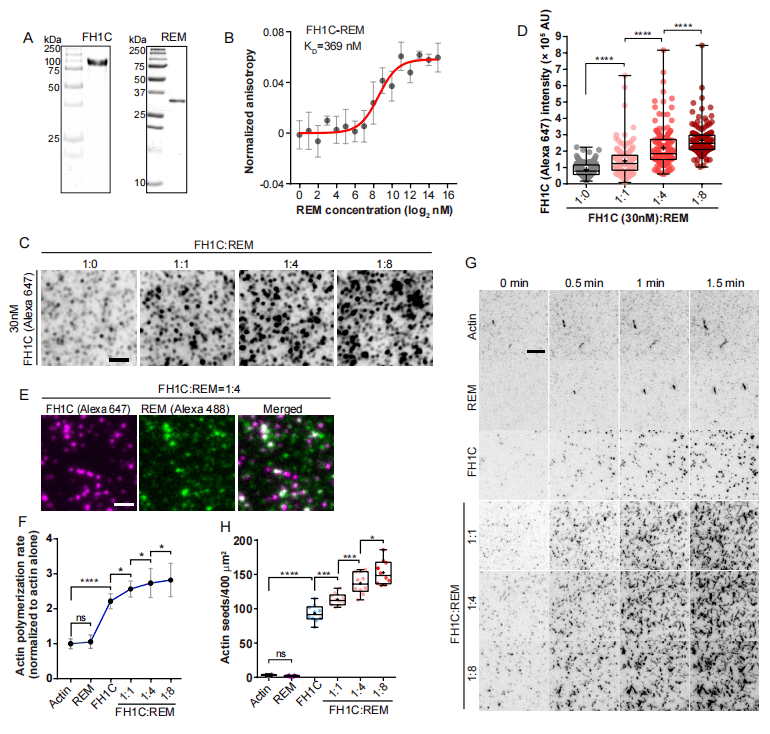
图3 AtREM1.2与I型formin相互作用并促进actin体外成核
Remorin蛋白已被证实具有N端IDR、中央盘绕(CC)结构域和C端膜锚定区(REM-CA)的特征。作者分别表达不同长度的remorin蛋白描述他们与FH1C蛋白的相互作用。REM-CC对FH1C表现出适度的亲和力,这与全长REM(REM-FL)(KD=369 nM)相似但略低;REM-IDR对FH1C的亲和力大大降低。REM的N端和C端都能独立地与FH1C发生微弱的结合。这表明除了IDR与FH1C的相互作用外,REMORIN的C端也可能与FH1C结合。作者又对对REM截短蛋白进行SEC分析,我们观察到相对于REM-FL,EM-IDR和REM-CC的洗脱峰都有显著变化,表明在没有IDR或CC的情况下,蛋白质的聚集水平明显下降。作者将这些不同的REM截短蛋白整合到AtFH6-GFP和Lifeact-Venus的遗传背景中。与AtREM1.2 FL不同,AtREM1.2 FL在子叶表皮细胞的PM上形成点状簇状分布,而AtREM1.2 IDR在PM上显示出高度弥散,没有点状的纳米域模式。与体外结果一致,作者没有观察到AtREM1.2 IDR过表达后AtFH6-GFP纳米聚类或肌动蛋白组装的增加。综上所述,作者通过体外和体内数据共同表明,IDR介导的AtREM1.2在质膜组装是招募formin和分子聚集以实现肌动蛋白重塑的关键因素之一(图4)。
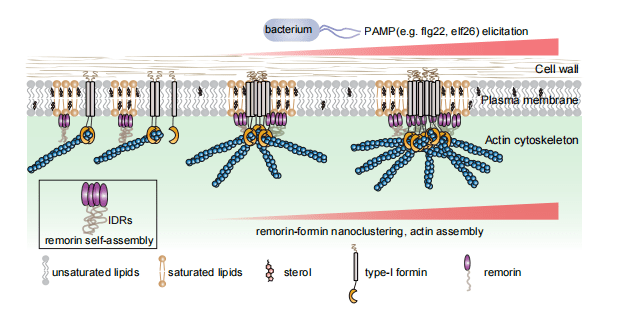
图5 作者提出的remorin-介导formin聚集和肌动蛋白组装工作模型
作者通过上述数据揭示了remorin通过招募formin在植物先天免疫过程中调控肌动蛋白重塑达到对抗病原菌的效果。这有助于人们加深植物免疫过程分子相变在其中发挥的作用。
本论文得到国自然基金、南洋理工大学启动经费和新加坡教育部的支持。
责编:李尘
植物科学最前沿,专注于植物科学前沿进展、资讯、招聘信息的发布及方法软件共享等。投稿及招聘请后台回复“投稿”,均为无偿;商务合作请联系微信ID:zwkxqy;返回搜狐,查看更多

